Indice |
Premessa all'articolo
Dopo i quattro articoli dedicati ai gas in cui abbiamo parlato di pressione, temperatura, legge dei gas ideali e miscele di gas e dei gas reali, chiudiamo "il capitolo gas" illustrando in via panoramica la teoria cinetica dei gas.
Ci proponiamo in questo articolo di ricavare una relazione tra le velocità molecolari e la temperatura.
Le ipotesi di partenza
La teoria cinetica dei gas fornisce una spiegazione microscopica della legge di Boyle e una descrizione meccanica microscopica della temperatura come misura dell'energia cinetica media delle molecole di un gas.
Le ipotesi di partenza della teoria cinetica dei gas sono le seguenti:
- un gas puro consiste in un grande numero di molecole identiche separate da distanze che sono grandi rispetto alle loro dimensioni;
- le molecole del gas sono costantemente in moto, in direzioni casuali e con una distribuzione di velocità;
- tra una collisione e l'altra le molecole non esercitano forze tra di esse, e quindi tra una collisione e l'altra le molecole si muovono in linea retta con velocità costante;
- le collisioni delle molecole con le pareti del recipiente sono elastiche : durante la collisione non c'è perdita di energia.
Il significato della temperatura
Cerchiamo di adoperare la teoria cinetica dei gas per ricavare una relazione tra pressione, volume e moto delle molecole in un gas ideale. Un confronto con la legge dei gas ideali consentirà di comprendere meglio il significato della temperatura.
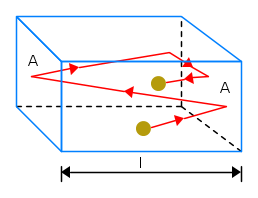
A tal fine consideriamo un recipiente con forma di una scatola rettangolare di lunghezza l con le facce ai due estremi di area A.
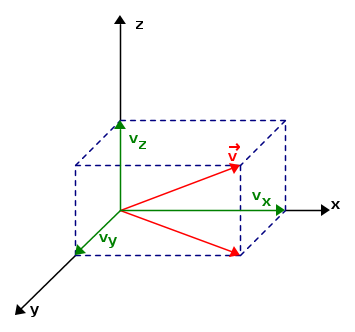
Poniamo nella scatola una singola molecola con velocità u in una certa direzione. Per indicare il valore della velocità in m / s e la direzione del movimento nella figura che segue, la rappresenteremo con una freccia (un vettore)  , la cui lunghezza è uguale al valore della velocità (scalare) u e che punta nella direzione del moto della molecola.
, la cui lunghezza è uguale al valore della velocità (scalare) u e che punta nella direzione del moto della molecola.
La velocità può essere rappresentata anche dalle sue componenti lungo i tre assi delle coordinate : vx, vy, vz.
Queste sono legate a u dalla relazione del teorema di Pitagora:

La quantità di moto di una molecola,  , è data dal prodotto tra la sua velocità e la sua massa, m. Quando la molecola compie una collisione elastica con una delle pareti di area A agli estremi della scatola, le componenti lungo y e z della velocità, vy e vz, non cambiano, mentre la componente lungo x (perpendicolare ad A) cambia di segno, come si può dedurre dalla figura seguente:
, è data dal prodotto tra la sua velocità e la sua massa, m. Quando la molecola compie una collisione elastica con una delle pareti di area A agli estremi della scatola, le componenti lungo y e z della velocità, vy e vz, non cambiano, mentre la componente lungo x (perpendicolare ad A) cambia di segno, come si può dedurre dalla figura seguente:
La variazione della quantità di moto lungo la componente x, Δpx,mol, è:


La quantità di moto totale del sistema (cioè molecola più scatola) deve conservarsi e quindi questa variazione di quantità di moto deve essere eguagliata da una uguale variazione di quantità di moto della parete:

Dopo questa collisione con la parete, la molecola inverte la sua direzione e finisce per collidere con la parete opposta e ritorna dopo ancora verso la prima parete. Fra i due urti può capitare anche che collida con la parete superiore od inferiore oppure con quelle laterali.
Questi urti, però, non cambiano vx e il tempo trascorso tra due collisioni con la parete iniziale non cambia (si veda in proposito la prima figura dell'articolo).
La distanza percorsa nella direzione x è 2l e la componente della velocità in quella direzione è vx, per cui il tempo che intercorre tra le collisioni tra le due pareti opposte è:

Ogni secondo la quantità di moto trasferita alla parete sarà data dalla variazione della quantità di moto per collisione, Δpx,parete diviso per Δt:

Per la seconda legge di Newton la forza esercitata sulla parete dalle ripetute collisioni della molecola è:

Supponiamo ora che nella scatola a muoversi sia un numero N grande di molecole indipendenti di massa m con componenti di velocità nella direzione x uguale a vx1, vx2, vx3 e così via.
La forza totale esercitata sulla parete dalle N molecole è pari alla somma delle forze esercitate da ciascuna delle molecole:

dove:

La quantità  è la media dei quadrati delle componenti lungo x della velocità delle N molecole e si ottiene sommando
è la media dei quadrati delle componenti lungo x della velocità delle N molecole e si ottiene sommando  per le N molecole e dividendo per N. La pressione è la forza totale esercitata sulla parete divisa per l'area A:
per le N molecole e dividendo per N. La pressione è la forza totale esercitata sulla parete divisa per l'area A:

Dato che Al è il volume V della scatola, si conclude che:

Le molecole gassose non hanno una direzione preferenziale di movimento, per cui  ,
,  e
e  saranno uguali tra di loro. Si ha quindi che:
saranno uguali tra di loro. Si ha quindi che:

e cioè:

dove  è la velocità quadratica media delle molecole del gas.
è la velocità quadratica media delle molecole del gas.
Dalla legge dei gas ideali:

si può scrivere:

Abbiamo ottenuto con questa equazione una relazione tra le velocità molecolari e la temperatura, che può essere anche semplificata.
Nell'equazione compare il numero di molecole N a sinistra e il numero di moli n a destra.
Ricordando che:

dove NA è il numero di Avogadro, dividendo ambo i membri per n otteniamo:

Qualche riflessione
Sull'equazione (1) possiamo fare due osservazioni.
PRIMA OSSERVAZIONE
L'energia cinetica di una molecola di massa m che si muove con velocità u è data da:

quindi l'energia cinetica media di NA molecole (1 mole) è pari a :

Questo è il lato sinistro dell'equazione, ma con il fattore  invece che
invece che  :
:

L'energia cinetica di una singola molecola,  , si ottiene dividendo
, si ottiene dividendo  per il numero di Avogadro:
per il numero di Avogadro:

dove kB è detta costante di Boltzmann, pari a R / NA. L'energia cinetica media delle molecole di un gas dipende solo dalla temperatura e non dipende dalla massa delle molecole o dalla loro densità numerica.
Questa relazione è il risultato più importante della teoria cinetica dei gas.
SECONDA OSSERVAZIONE
Notiamo che se m è la massa di una singola molecola allora la massa di 1 mole di molecole è pari a NAm, che verrà indicato con il simbolo M.
Possiamo scrivere quindi che:

La velocità quadratica media di una molecola di gas sarà direttamente proporzionale alla temperatura e inversamente proporzionale alla sua massa.
Le molecole si muovono più velocemente a temperatura più elevate, mentre molecole leggere si muovono più velocemente di quelle pesanti alla stessa temperatura.
Bibliografia
Chimica moderna - Oxtoby, Gillis, Campion.

 Elettrotecnica e non solo (admin)
Elettrotecnica e non solo (admin) Un gatto tra gli elettroni (IsidoroKZ)
Un gatto tra gli elettroni (IsidoroKZ) Esperienza e simulazioni (g.schgor)
Esperienza e simulazioni (g.schgor) Moleskine di un idraulico (RenzoDF)
Moleskine di un idraulico (RenzoDF) Il Blog di ElectroYou (webmaster)
Il Blog di ElectroYou (webmaster) Idee microcontrollate (TardoFreak)
Idee microcontrollate (TardoFreak) PICcoli grandi PICMicro (Paolino)
PICcoli grandi PICMicro (Paolino) Il blog elettrico di carloc (carloc)
Il blog elettrico di carloc (carloc) DirtEYblooog (dirtydeeds)
DirtEYblooog (dirtydeeds) Di tutto... un po' (jordan20)
Di tutto... un po' (jordan20) AK47 (lillo)
AK47 (lillo) Esperienze elettroniche (marco438)
Esperienze elettroniche (marco438) Telecomunicazioni musicali (clavicordo)
Telecomunicazioni musicali (clavicordo) Automazione ed Elettronica (gustavo)
Automazione ed Elettronica (gustavo) Direttive per la sicurezza (ErnestoCappelletti)
Direttive per la sicurezza (ErnestoCappelletti) EYnfo dall'Alaska (mir)
EYnfo dall'Alaska (mir) Apriamo il quadro! (attilio)
Apriamo il quadro! (attilio) H7-25 (asdf)
H7-25 (asdf) Passione Elettrica (massimob)
Passione Elettrica (massimob) Elettroni a spasso (guidob)
Elettroni a spasso (guidob) Bloguerra (guerra)
Bloguerra (guerra)